HESA Rapport du Comité
Si vous avez des questions ou commentaires concernant l'accessibilité à cette publication, veuillez communiquer avec nous à accessible@parl.gc.ca.
Vers la science ouverte : promouvoir l’innovation en recherche et en développement pharmaceutique, et l’accès à des médicaments abordables au Canada et à l’étranger
Introduction
Au Canada et ailleurs dans le monde, on s’inquiète des coûts toujours plus élevés des nouveaux médicaments, qui risquent de devenir hors de prix pour la population, et grèvent excessivement les budgets consacrés à la santé[1]. Par ailleurs, le rôle de la recherche subventionnée par l’État dans la création des médicaments novateurs fait que « les conditions entourant le financement public de la R et D font l’objet d’une attention accrue afin de déterminer si elles sont adéquates et garantissent que les médicaments et les autres technologies de la santé sont abordables pour les publics ayant financé leur développement[2] ». C’est dans ce contexte que la Chambre des communes a adopté, le 8 novembre 2017, l’affaire émanant des députés M-132, qui énonce ce qui suit :
Que le Comité permanent de la santé soit chargé de faire une étude sur les moyens de faire profiter davantage le public de la recherche en santé subventionnée par le fédéral, avec pour objectifs la réduction du coût des médicaments et l’amélioration de l’accès aux médicaments, au Canada comme ailleurs; et que le Comité fasse rapport de ses conclusions et de ses recommandations à la Chambre dans l’année suivant l’adoption de la présente motion[3].
Le 16 et le 18 octobre 2018, le Comité permanent de la santé de la Chambre des communes (le Comité) a tenu, dans le cadre de cette étude, deux réunions qui lui ont permis d’entendre divers témoins, dont des chercheurs médicaux, des organismes de financement de la recherche en santé, des associations de patients et des organisations de la société civile. Le Comité a aussi reçu 23 mémoires écrits et 7 documents d’information. Le présent rapport, qui se fonde sur les témoignages des participants aux réunions et les mémoires reçus, explore le rôle que le gouvernement fédéral peut jouer pour favoriser la recherche et le développement pharmaceutiques au Canada et ailleurs dans le monde de manière à accroître l’abordabilité et l’accessibilité des médicaments. Le rapport commence par une description des principaux défis que pose le modèle actuel de recherche-développement pharmaceutique. Ensuite, on examine comment le gouvernement fédéral, pour répondre à certains de ces défis, pourrait accroître le financement public de la recherche en santé, et plus particulièrement la recherche biomédicale translationnelle (et les essais cliniques); favoriser l’élaboration de modèles novateurs de découverte de médicaments; et établir pour la recherche-développement pharmaceutique des priorités stratégiques conformes aux besoins médicaux des populations canadienne et mondiale.
Aperçu des défis dans le secteur de la recherche-développement pharmaceutique au Canada et à l’étranger
Habituellement, les médicaments sont mis au point par une société pharmaceutique à but lucratif qui réalise elle-même les étapes du processus de R-D (voir la figure 1)[4]. À l’étape de la découverte du processus de création du médicament, on identifie et on valide une « cible » biologique liée à une maladie donnée; il s’agit d’une protéine ou d’un gène pouvant être ciblé par une molécule ayant le potentiel d’être transformée en médicament[5]. Un composé chimique qui agira sur la cible biologique est ensuite mis au point. La sûreté et l’efficacité de ce candidat-médicament sont testées par des essais précliniques et cliniques. Si ceux-ci réussissent, le médicament est homologué auprès des autorités de réglementation, et l’autorisation de mise en marché est demandée. Enfin, l’entreprise pharmaceutique pourra fabriquer le médicament et en promouvoir la vente par des activités de marketing.
Des droits de propriété intellectuelle – brevet et protection des données – empêchent toute autre entreprise (sauf si elle a une licence) de fabriquer, d’utiliser ou de vendre le médicament pendant une certaine période, ce qui confère un monopole sur le marché à la société pharmaceutique créatrice du médicament[6]. Au Canada, en vertu de l’article 44 de la Loi sur les brevets[7], les entreprises pharmaceutiques peuvent demander une période d’exclusivité de 20 ans pour leurs inventions. Certes, les fabricants de médicaments génériques peuvent contester le brevet avant la fin de la période d’exclusivité aux termes du Règlement sur les médicaments brevetés (avis de conformité) (DORS/93-133)[8]. Cependant, le Règlement sur les aliments et drogues accorde aux « drogues innovantes », au sens du paragraphe C.08.004.1(1), une période de protection des données de huit ans[9], laquelle empêche les fabricants de médicaments génériques d’utiliser les données sur la sûreté et l’efficacité du fabricant d’origine pour obtenir de Santé Canada l’approbation de vendre leurs versions du médicament (section C.08.004.1(3))[10]. Cette disposition confère donc aux fabricants de médicaments innovants une période d’exclusivité de huit ans sur le marché.
Les établissements de recherche subventionnés par l’État, comme les universités et les laboratoires financés par le gouvernement, participent eux aussi au processus de développement pharmaceutique. Les scientifiques qui y travaillent effectuent des recherches aux étapes de la découverte et de l’élaboration préclinique, puis leur université ou le gouvernement concède par licence aux sociétés pharmaceutiques, en échange de redevances, les droits de propriété intellectuelle découlant des découvertes. Ce sont les entreprises pharmaceutiques qui poursuivront le développement du produit, effectueront les essais cliniques et se chargeront de la commercialisation[11].
Figure 1 — Le processus de recherche-développement pharmaceutique

Source : Figure préparée par la Bibliothèque du Parlement à partir de données tirées de Chas Bountra et al., A New Pharmaceutical Commons: Transforming Drug Discovery, Oxford Martin Policy Paper, 2017.
Certains témoins ont dit au Comité que le processus de R-D tel qu’il est traditionnellement mené par les entreprises pharmaceutiques ne fonctionne plus[12]. Selon eux, les médicaments qu’il sert à produire sont onéreux et coûtent très cher aux systèmes publics de soins de santé de par le monde. Par exemple, selon Mme Louise Kyle, membre du comité de coordination pour l’Amérique du Nord, Universités alliées pour les médicaments essentiels (UAME), le sofosbuvir est un médicament qui peut guérir plus de 90 % des cas d’hépatite C[13]. Il a été mis au point sur une période de 10 ans grâce aux subventions que le Département des anciens combattants des États-Unis et les National Institutes of Health américains ont octroyées à la Emory University[14]. Ce médicament a d’abord été commercialisé par Pharmasset, puis acheté par Gilead Sciences. Aujourd’hui, il coûte 1000 $ la pilule, et le coût du traitement complet atteint 68 714 $CAD[15]. Selon le Conseil d’examen du prix des médicaments brevetés, le sufosbuvir et les autres nouveaux médicaments servant au traitement de l’hépatite C ont représenté une hausse de 8 % du coût des régimes publics d’assurance-médicaments au Canada en 2015-2016[16]. Le Dr Jason Nickerson, conseiller aux affaires humanitaires, Médecins Sans Frontières, a expliqué au Comité que les sociétés pharmaceutiques justifient le prix élevé de leurs médicaments par les investissements qu’elles ont dû faire en R-D pour les mettre au point[17]. Elles citent d’ailleurs une étude du Tufts Centre for Drug Development, qui estime qu’il en coûte 2,6 milliards de dollars US pour commercialiser une nouvelle thérapie efficace[18]. Cependant, le Dr Nickerson a expliqué que, vu l’absence de transparence, on ignore combien d’argent les entreprises pharmaceutiques investissent dans la R-D, ce qui ne nous permet guère de déterminer si ces estimations sont exactes, ou si des fonds publics ont contribué à la R-D, comme dans le cas du sofosbuvir[19]. De plus, selon ce témoin, les entreprises pharmaceutiques sans but lucratif montrent que les coûts de R-D des nouvelles entités chimiques peuvent être beaucoup moindres, et se situer entre 144 millions et 216 millions de dollars CAN[20].
À l’échelle mondiale, malgré littéralement des billions de dollars de financement public au cours des dernières décennies et un montant égal de financement du secteur privé, nous mettons au point trop peu de nouveaux médicaments. Ce qui est pire, c’est que les prix des médicaments que nous mettons au point nuiront à notre système de soins de santé et seront inabordables pour la plupart des gens sur la planète. Il est évident que quelque chose cloche.
Dr Aled Edwards, chef de la direction, Structural Genomics Consortium
Le Comité a aussi entendu que les sociétés pharmaceutiques du Canada et du monde ne concentrent pas leurs investissements sur la création de médicaments et de traitements qui répondent aux besoins médicaux urgents de la population[21]. Par exemple, Mme Rachel Kiddell‑Monroe, membre du conseil, Universités alliées pour les médicaments essentiels (UAME), a expliqué que les entreprises pharmaceutiques ne priorisaient pas le développement de traitements plus efficaces et plus abordables contre la tuberculose :
Même ici, au Canada, nous regardons nos populations inuites souffrir 300 fois plus de la tuberculose que notre population non autochtone née au Canada.
La crise nationale que nous connaissons au Canada aujourd’hui concernant la tuberculose reflète aussi une crise mondiale : elle tue deux millions de personnes par an. Des personnes qui souffrent aujourd’hui de la tuberculose multirésistante meurent parce qu’elles n’ont pas accès au traitement dont elles ont besoin.
Le traitement qui existe depuis plus de 63 ans et nécessite 14 000 comprimés et plusieurs injections, qui laisse une personne sur deux sourde, c’est celui que la plupart des gens souffrant de tuberculose multirésistante utilisent aujourd’hui. Il existe un nouveau médicament, un incroyable nouveau médicament qui pourrait vraiment changer les choses, mais il coûte juste trop cher; il est hors de portée de la plupart de ces gens[22].
Le Dr Jason Nickerson a ajouté ce qui suit :
Si je peux ajouter quelque chose, nous avons un problème majeur avec la mise au point de médicaments pour la tuberculose. Nous épuisons tout simplement les options viables, et c’est un problème mondial. Les Normes canadiennes pour la lutte antituberculeuse reflètent des options de traitement mondiales qui sont accessibles à tout le monde, et les options sont assez limitées. C’est une maladie pour laquelle on acquiert de plus en plus une résistance aux médicaments qui sont offerts.
Au cours des 40 dernières années, sinon plus, deux médicaments sont entrés sur le marché concernant une maladie pour laquelle il y a chaque année 10 millions de nouveaux cas et près de 2 millions de décès — deux médicaments depuis 1971. Aucun des deux n’est enregistré au Canada[23].
Le Comité a aussi entendu du Dr Aled Edwards, chef de la direction, Structural Genomics Consortium, que le modèle de R-D pharmaceutique actuel, parce qu’il priorise le secret, les brevets et le financement privé, entrave la création de traitements innovants répondant à des problèmes médicaux d’actualité, comme la maladie d’Alzheimer[24]. Le Dr Aled Edwards a dit que le secret que maintiennent les entreprises pharmaceutiques fait en sorte qu’elles font souvent chacune de leur côté les mêmes recherches, ce qui augmente les coûts et entraîne, pour les participants aux essais cliniques, des risques inutiles
La maladie d’Alzheimer est un excellent exemple. L’hypothèse de la bêta-amyloïde a été testée par une dizaine de sociétés. Environ 20 milliards de dollars ont probablement été investis dans cette hypothèse. Toutes les sociétés l’ont fait en secret. Nous ne savons toujours pas si cette hypothèse est valide ou non en ce qui concerne la maladie d’Alzheimer. C’était un terrible gaspillage d’argent. Si on avait imaginé un univers différent dans lequel nous aurions testé cette hypothèse une ou deux fois au grand jour, alors 10 personnes n’auraient pas eu à dépenser 2 milliards de dollars chacune, et nous aurions trouvé la réponse de manière transparente[25].
Selon le Dr Aled Edwards, la méthode actuelle de R-D pharmaceutique pousse de plus les sociétés pharmaceutiques à ne pas s’intéresser aux domaines de recherche qui ne sont pas lucratifs ou qui sont considérés comme trop risqués – alors qu’ils peuvent en fait être prometteurs[26].
Des témoins ont aussi dit au Comité que la R-D pharmaceutique effectuée au Canada est en fait très limitée[27] et ce, alors que le prix des médicaments génériques et brevetés est en moyenne de 30 % plus élevé au Canada que dans les pays de l’Organisation de coopération et de développement économiques, exception faite des États‑Unis[28]. De plus, en contrepartie de la protection accrue des brevets accordée par les modifications de 1987 à la Loi sur les brevets, l’industrie des médicaments de marque du Canada s’était engagée à porter à 10 % de ses ventes le montant investi annuellement dans la R-D[29]. Or, le Comité a entendu que les dépenses annuelles de R-D des entreprises de médicaments d’origine, exprimées comme pourcentage des ventes, connaissaient une chute constante au Canada depuis 2003; elles n’étaient plus que de 4,1 % en 2017[30]. Comme l’a dit le Dr Aled Edwards, « [i]l y avait autrefois au Canada des installations mondiales de recherche et de développement, mais il n’en reste que très peu[31] ».
Enfin, les témoins ont expliqué que les universités canadiennes ne profitent pas de l’octroi par licence des droits de propriété intellectuelle qui découlent de leurs recherches biomédicales, parce que leurs découvertes en laboratoire ont lieu si tôt dans le processus de mise au point des médicaments que le rendement n’est jamais à la hauteur de l’investissement[32]. C’est donc dire, comme l’a indiqué au Comité le Dr Aled Edwards, que les universités ne touchent pas de grandes redevances sur la propriété intellectuelle qu’elles cèdent par licence aux sociétés pharmaceutiques :
Si vous effectuez un simple contrôle financier pour savoir combien nous gagnons et combien nous perdons, dans nos universités, vous constaterez que nous perdons de l’argent sur notre portefeuille de propriété intellectuelle. La propriété intellectuelle que nous avons en est à un stade précoce; ce n’est pas encore un produit. […] Ce ne serait pas une si mauvaise idée que d’arrêter de prétendre que nous sommes de petites entreprises au sein des universités[33].
Comment le gouvernement fédéral pourrait favoriser l’innovation en matière de recherche et développement pharmaceutiques, au Canada et dans le monde
Les témoins ont fait valoir au Comité que le gouvernement fédéral, pour répondre à ces défis, pourrait accroître ses investissements dans la recherche en santé; promouvoir la création de modèles novateurs en R-D pharmaceutique; et établir dans ce domaine des priorités stratégiques conformes aux besoins médicaux des populations canadienne et mondiale.
A. Financement fédéral de la recherche en santé
Les Instituts de recherche en santé du Canada (IRSC) forment le principal organisme fédéral de subvention de la recherche médicale au Canada. En 2017-2018, ils ont octroyé un financement de 1 milliard de dollars dans ce domaine, et 46 % de cette somme (472 millions) de dollars, visait la recherche biomédicale[34]. Selon le Dr Salim Yusuf, professeur éminent de médecine, Institut de recherche de la santé de la population, McMaster University et Hamilton Health Sciences, le gouvernement fédéral doit accroître le financement qu’il accorde à la recherche médicale, par l’intermédiaire des IRSC, pour promouvoir l’innovation dans le secteur de la R-D pharmaceutique au Canada. Il a expliqué que l’innovation dans ce domaine découle de la recherche effectuée dans toutes les disciplines – science fondamentale, science de la population et de la santé, et découvertes en laboratoire de l’industrie[35]. Par exemple, le Comité a été informé que les antihypertenseurs qui aident à réduire le nombre d’AVC et d’infarctus n’auraient pas été mis au point par l’industrie si des chercheurs en santé publique n’avaient pas constaté une incidence accrue des AVC chez les personnes souffrant d’hypertension[36]. De même, le Dr Salim Yusuf a souligné qu’il est important de financer la recherche translationnelle, comme les essais cliniques, qui servent à déterminer si les découvertes faites en laboratoire peuvent être utilisées sans danger par l’homme et intégrées au système de soins de santé.
Le Dr Salim Yusuf a dit au Comité que les investissements du Canada dans la recherche biomédicale dans son ensemble sont faibles si on les compare à ceux des autres pays industrialisés. Ainsi, en 2012, le Canada a investi 5,3 milliards de dollars US dans la recherche médicale; de ce montant, 3,3 milliards de dollars US provenaient de sources publiques, et 2,0 milliards de dollars US, de l’industrie. Or, ces montants sont inférieurs aux investissements dans la recherche médicale qui sont faits aux États‑Unis, en Europe de l’Ouest, au Japon, en Australie et en Corée du Sud[37]. Le Comité a aussi été informé que, par habitant et en proportion du produit intérieur brut, le financement accordé par les IRSC « représente le quart de celui des États-Unis et la moitié de celui du Royaume-Uni, donc, par rapport à la taille de notre économie et de notre population, nous sommes sous-financés par les sources publiques » (voir figure 2)[38].
Figure 2 — Financement fédéral de la santé, par habitant et exprimé en pourcentage du produit intérieur brut, 2012
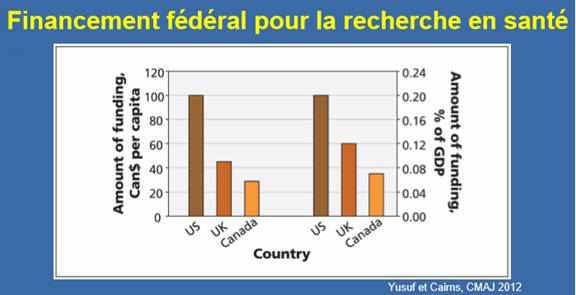
Source : Dr Salim Yusuf, professeur éminent de médecine, Institut de recherche de la santé de la population, McMaster University et Hamilton Health Sciences, La recherche biomédicale au Canada, mémoire présenté au HESA, octobre 2018.
Point très important, le Dr Salim Yusuf s’est dit d’avis que le financement fédéral manifeste un déséquilibre entre la recherche biomédicale pure et les essais cliniques. En effet, il a expliqué que seulement 3,3 % du budget des IRSC est affecté aux essais cliniques, contre 11 % de celui des National Institutes of Health des États-Unis, et entre 20 % et 25 % de celui du National Institute for Health Research du Royaume-Uni[39]. Or, en raison de ce manque de subventions publiques, il est difficile aux chercheurs canadiens de donner une application pratique à leurs découvertes, et les essais cliniques deviennent l’apanage de l’industrie :
[À] l’heure actuelle, pour effectuer un essai clinique après avoir reçu du financement, vous devez suivre environ 100 différentes étapes. Pour un essai clinique d’envergure, ces étapes représentent environ 1 million de dollars. Il est très difficile pour un chercheur universitaire de le faire. L’industrie possède les ressources et la main-d’œuvre nécessaires pour y arriver[40].
Par conséquent, les témoins ont recommandé la création, dans le cadre des IRSC, d’un mécanisme de financement fédéral axé sur la réalisation d’essais cliniques au Canada. Ce fonds pourrait compléter le financement de l’industrie dans un rapport de 1 à 2, selon lequel le gouvernement fédéral investirait 1 $ pour chaque montant de 2 $ investi par l’industrie[41]. Dans leur mémoire écrit, les IRSC ont parlé de leur programme des Réseaux de centres d’excellence, qui aident à faire la transition entre les recherches de découverte et l’étape des premiers essais cliniques. Par exemple, ce programme finance des organismes tels que Accel-RX Health Sciences Accelerator, qui fournit à son tour investissements et expertise aux projets prometteurs de chercheurs universitaires ou entreprises de biotechnologie qui se proposent de valider des cibles pharmacologiques ou de cerner des candidats-médicaments à soumettre à l’essai clinique[42].
Chaque chercheur peut avoir de bonnes idées, mais réaliser un essai clinique avec 10 000 personnes est irréaliste. Certains mécanismes de soutien à ces essais réduiraient certainement les obstacles.
Dr Keith Fowke, professeur, Département de la microbiologie médicale et des maladies infectieuses, Université du Manitoba
B. Promouvoir l’élaboration de modèles novateurs de recherche-développement pharmaceutique
[J]e ne sais pas; j’aimerais pouvoir donner une meilleure réponse et j’aimerais qu’une compagnie pharmaceutique ait bon cœur.
Louise Kyle, membre du comité de coordination pour l’Amérique du Nord, Universités alliées pour les médicaments essentiels
Les témoins ont expliqué au Comité que, en plus d’accroître le financement de la recherche en santé pour favoriser l’innovation de la R-D pharmaceutique au Canada, le gouvernement fédéral devait aussi soutenir l’élaboration de nouveaux modèles de R-D pharmaceutique qui prioriseraient l’abordabilité des médicaments. Les témoins ont donc présenté au Comité différentes approches de la R-D pharmaceutique et discuté des façons dont le gouvernement fédéral pourrait en appuyer le développement.
(i) Les modèles de R-D pharmaceutique de « science ouverte »
Le Comité a appris que les modèles de recherche biomédicale dits de « science ouverte » sont des partenariats public-privé où les universités, les sociétés pharmaceutiques, les gouvernements, les organisations non gouvernementales et les organismes de bienfaisance du domaine de la santé acceptent de collaborer à la découverte et au développement de médicaments[43]. Dans le cadre de ces partenariats, les ressources, les capacités, les fonds et la propriété intellectuelle des secteurs public et privé sont mis en commun à l’appui du processus de R-D pharmaceutique. Les résultats scientifiques qui en découlent restent ouverts dans le domaine public; ils ne sont pas brevetés, et les chercheurs peuvent y puiser librement[44]. De plus, les membres du partenariat s’engagent à ce que les médicaments commerciaux qui en résulteront soient vendus à un prix abordable. Cet objectif peut être réalisé au moyen d’une licence, laquelle accorde à une entreprise pharmaceutique le droit de fabriquer et de vendre un produit final à la condition qu’elle le vende à un prix abordable, puisqu’elle n’a pas eu à assumer la totalité du coût ou des risques financiers du développement[45]. Les membres du partenariat public-privé peuvent aussi conclure une licence non exclusive, aux termes de laquelle plus d’une société sera autorisée à produire le médicament, ce qui créera de la concurrence et réduira le prix du produit[46].
Figure 3 — Les modèles de R-D pharmaceutique de science ouverte
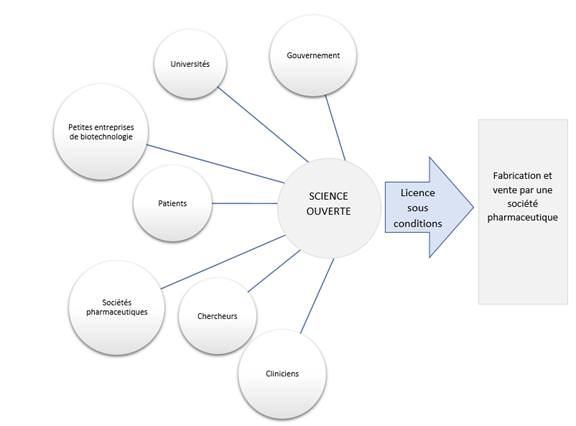
Source : Bibliothèque du Parlement
Le Dr Aled Edwards a parlé au Comité du Structural Genomics Consortium, un partenariat public‑privé mondial conclu avec l’industrie pharmaceutique. Fort de son modèle de science ouverte, ce partenariat a réussi à attirer un investissement de 200 millions de dollars des entreprises pharmaceutiques et à accélérer la découverte de médicaments en aval[47]. Vu le succès de cette initiative, le Dr Edwards a fondé en 2017 M4K Pharma Inc., une entreprise pharmaceutique de science ouverte spécialisée dans le traitement de maladies infantiles rares. Grâce au financement et aux contributions de Génome Canada, de l’Institut ontarien de recherche sur le cancer et d’entreprises pharmaceutiques, M4K Pharma a mis au point un candidat-médicament pour combattre le gliome pontique intrinsèque diffus, un cancer cérébral mortel qui s’attaque aux enfants.
Le Dr Jason Nickerson a expliqué au Comité que Médecins Sans Frontières, en collaboration avec cinq établissements de recherche publics, a mis sur pied une initiative similaire appelée Drugs for Neglected Diseases (DNDi)[48]. Il s’agit d’un partenariat sans but lucratif qui vise à développer des traitements pour les populations négligées. Grâce au financement public et privé, l’initiative DNDi a réussi, après des dépenses de 375 millions de dollars canadiens, à mettre au point sept nouveaux traitements pour cinq maladies (la malaria, la maladie du sommeil, la leishmaniose virale, la maladie de Chagas et l’infection au VIH chez les enfants). L’initiative DNDi octroie par licence ses découvertes à des entreprises pharmaceutiques, mais la licence est assortie de conditions sur l’accessibilité et l’abordabilité du médicament dans les pays et les populations où la maladie est endémique. Quant aux redevances, elles sont réinvesties dans la recherche.
Les témoins ont discuté des façons dont le gouvernement fédéral pourrait promouvoir la R-D pharmaceutiques de science ouverte. Des représentants des UAME ont recommandé que les IRSC ne financent la recherche en santé qu’à la condition qu’y soit incorporée une « licence donnant un libre accès[49] ». Cette licence obligerait les chercheurs et les universités dont la recherche est subventionnée par le gouvernement fédéral à exiger l’abordabilité et l’accessibilité dans les licences de commercialisation qu’ils accordent aux fabricants, ou à négocier des licences non exclusives qui encourageront la concurrence. Le Comité a entendu que la licence donnant un libre accès est adoptée par l’Université de la Colombie-Britannique, l’Université Yale, l’Université Johns Hopkins et l’Université Harvard, ainsi que par d’autres établissements universitaires de pointe en Europe[50].
Dans leur mémoire écrit au Comité, le Dr Edwards et Max Morgan, du Structural Genomics Consortium, ont recommandé d’ouvrir les programmes de financement de la recherche des IRSC aux partenariats public-privé qui, au lieu du modèle commercial axé sur la propriété intellectuelle, suivent le modèle ouvert de découverte de médicaments[51]. Lors de sa comparution devant le Comité, l’organisme Génome Canada a recommandé au gouvernement fédéral de renouveler l’entente de contribution de 630 millions de dollars sur cinq ans conclue avec lui pour qu’il puisse continuer de soutenir des initiatives comme le Structural Genomics Consortium[52].
Le Dr Edwards a aussi recommandé à Santé Canada de modifier le Règlement sur les aliments et drogues de manière à ce qu’une désignation spéciale soit accordée aux médicaments issus du modèle de découverte de science ouverte, à la condition que l’entreprise s’engage à vendre à un prix abordable son médicament innovant et à assurer le libre accès à ses données[53]. Cette désignation spéciale rendrait les sociétés pharmaceutiques admissibles à des mesures incitatives comme l’examen accéléré des demandes d’approbation et la prolongation de la période d’exclusivité sur le marché et de protection des données sans recours aux brevets. Enfin, la Dre Karen Lee, vice‑présidente nationale, Recherche, Société canadienne de la sclérose en plaques, a recommandé au gouvernement fédéral de créer un cadre pour assurer une coordination accrue afin de mieux tirer profit, en vue du développement de traitements novateurs, des investissements dans la recherche médicale des gouvernements, des universités, de l’industrie privée et des organismes de bienfaisance[54].
(ii) Adaptation de médicaments existants
Des médicaments existants qui sont sûrs, abordables et disponibles à l’échelle mondiale peuvent être adaptés au traitement de nouvelles maladies. Selon le Dr Keith Fowke, professeur, Département de la microbiologie médicale et des maladies infectieuses, Université du Manitoba, le financement fédéral de la recherche sur ces adaptations est une autre façon de réduire les coûts de développement des médicaments et d’assurer l’abordabilité des traitements[55]. Il a expliqué au Comité qu’il a fait des recherches – subventionnées par les IRSC – sur la réduction de l’inflammation des cellules qui, dans les voies génitales, sont vulnérables au VIH. Ses recherches ont montré que l’aspirine réduisait le nombre des cellules cibles du VIH dans les voies génitales de 35 %, découverte qui ouvre la voie à des essais cliniques sur l’utilisation de l’aspirine pour contrer la propagation du VIH/SIDA. Le Dr Fowke a recommandé aux IRSC de continuer de soutenir la recherche fondamentale novatrice qui vise l’adaptation à de nouvelles maladies de médicaments génériques faciles d’accès, puisque cette approche – qui utilise des médicaments existants – réduit les délais et les coûts de R-D. Selon le Dr Jason Nickerson, l’initiative DNDi a aussi concentré ses efforts de recherche sur l’adaptation de médicaments existants au traitement de nouvelles maladies; cette approche a coûté entre 14 millions et 58 millions de dollars canadiens à l’organisme.
(iii) Fabrication publique des médicaments essentiels
Le Comité a aussi entendu que le Brésil et l’Inde réussissent à assurer l’accès abordable aux médicaments essentiels grâce à la fabrication étatique de médicaments génériques[56]. Le Dr Salim Yusuf a souligné que cette approche pourrait servir à réduire à long terme le coût des médicaments au Canada, les prix des médicaments génériques y étant « de cinq à dix fois plus élevés qu’aux États-Unis. Ils sont aussi plusieurs fois supérieurs à ceux du Royaume‑Uni[57]. »
C. Création d’un cadre stratégique sur le financement fédéral de la recherche en santé au Canada et à l’étranger
Enfin, les Drs Nickerson et Yusuf ont dit au Comité que le gouvernement fédéral devait établir un cadre stratégique dans lequel seraient établies les priorités de la recherche en santé, priorités qui devraient correspondre aux besoins médicaux de la population, au Canada ou à l’étranger[58]. Il est vrai que divers ministères et organismes fédéraux, dont les IRSC, l’Agence de la santé publique du Canada et Affaires mondiales Canada, proposent des priorités nationales et internationales en matière de financement fédéral de la recherche médicale, mais les témoins ont dit qu’il serait nécessaire de réviser et de mieux coordonner ces priorités à la grandeur du gouvernement, question de vérifier si elles répondent aux besoins médicaux de la population. Ce processus de priorisation aiderait à cerner les secteurs où le gouvernement fédéral doit concentrer ses investissements en R-D pharmaceutique, afin de mieux tirer parti de l’expertise en la matière des gouvernements, des universités, de l’industrie et de la société civile du Canada[59].
Observations et recommandations du Comité
L’étude du Comité a fait ressortir qu’il faut accroître l’investissement public dans la recherche médicale pour promouvoir l’innovation dans la R-D pharmaceutique au Canada. Les témoins ont affirmé qu’une augmentation des investissements fédéraux en recherche médicale dans tous les domaines – recherche fondamentale, science de la population et de la santé et essais cliniques – entraînerait de nouvelles idées qui mèneraient à la découverte de nouveaux traitements. Plus précisément, on a dit au Comité que les IRSC devaient consacrer des investissements fédéraux ciblés aux essais cliniques afin de faciliter la transformation du résultat des recherches de découverte en produits pharmacologiques sûrs et efficaces chez l’être humain. Cependant, le Comité a aussi entendu que le financement fédéral de la R-D pharmaceutique devait mener à la création de médicaments et de technologies médicales abordables. Pour ce faire, les témoins ont recommandé que les chercheurs qui touchent des subventions fédérales soient obligés d’intégrer l’abordabilité et l’accessibilité aux conditions des licences qu’ils accordent aux fabricants de médicaments, ou de négocier des licences non exclusives. Ils ont aussi recommandé au gouvernement fédéral de favoriser, par l’intégration d’incitatifs à la réglementation ou d’autres mesures, la mise au point de modèles de R-D pharmaceutique qui priorisent le libre accès aux résultats de la recherche et l’abordabilité des médicaments. Enfin, selon les témoins, il est nécessaire que le gouvernement fédéral énonce des priorités pour la création de nouveaux modèles novateurs de R-D pharmaceutique et établisse des partenariats entre les gouvernements, les organismes de bienfaisance, les universités et l’industrie privée afin de tirer parti du financement et de l’expertise dans le domaine de la santé. Le Comité est du même avis que les témoins et recommande ce qui suit :
Recommandation 1
Que, par l’entremise des Instituts de recherche en santé du Canada, le gouvernement du Canada crée un mécanisme de financement consacré à la recherche et à l’infrastructure nécessaires à la réalisation d’essais cliniques au Canada.
Recommandation 2
Que le gouvernement du Canada porte le financement de la recherche et de l’infrastructure nécessaires aux essais cliniques au Canada à 10 % du budget des Instituts de recherche en santé du Canada, afin que ce financement soit au niveau de celui que versent les pays qui sont des leaders dans ce domaine, comme le Royaume-Uni et les États‑Unis.
Recommandation 3
Que le gouvernement du Canada envisage des moyens d’encourager les essais cliniques de médicaments pharmaceutiques au Canada, d’encourager et de soutenir la production de ces médicaments au Canada à un prix moindre, et de fournir du capital de risque aux promoteurs.
Recommandation 4
Que les Instituts de recherche en santé du Canada imposent l’obligation d’accorder une licence donnant un libre accès aux chercheurs qu’ils subventionnent, si ceux-ci souhaitent commercialiser les résultats de leurs recherches.
Recommandation 5
Que les Instituts de recherche en santé du Canada intègrent à leurs programmes actuels de recherche-développement le soutien à la mise au point de modèles de découverte de médicaments fondés sur la science ouverte.
Recommandation 6
Que les Instituts de recherche en santé du Canada élaborent un cadre sur la science ouverte visant à soutenir la collaboration et à tirer parti du financement de la recherche entre les différents partenaires de la recherche-développement pharmaceutique, notamment les organismes de bienfaisance, les universités, les gouvernements et l’industrie privée.
Recommandation 7
Que Santé Canada instaure dans la réglementation des incitatifs pour les entreprises pharmaceutiques qui s’engagent à ouvrir l’accès à leurs données de recherche et à vendre leurs produits à un prix abordable.
Recommandation 8
Que le gouvernement du Canada réalise, pour accroître la coordination, un examen stratégique des priorités en financement de la recherche médicale de ses ministères et organismes, y compris Santé Canada, l’Agence de la santé publique du Canada, les Instituts de recherche en santé du Canada, Affaires mondiales Canada et Innovation, Sciences et Développement économique Canada.
Recommandation 9
Que le gouvernement du Canada envisage la faisabilité d’adopter la production étatique des médicaments génériques.
[1] Suerie Moon, Ph. D., directrice de la recherche au Global Health Center et chargée d’enseignement invitée, Programmes interdisciplinaires, Institut de hautes études internationales et du développement, Genève, mémoire au Comité permanent de la santé de la Chambre des communes (HESA), 18 octobre 2018.
[2] Ibid.
[3] Chambre des communes, Parlement du Canada, Journaux, 1re session, 42e législature, 8 novembre 2017.
[4] Chas Bountra et al., A New Pharmaceutical Commons: Transforming Drug Discovery, Oxford Martin Policy Paper, 2017.
[5] Daniel L. Shaw, « Is Open Science the Future of Drug Development? », Yale Journal of Biology and Medicine, mars 2017, vol. 90, no 1, p. 147–151.
[6] University College London, The people’s prescription: Re-imagining health innovation to deliver public value, document d’information remis au HESA, octobre 2018.
[7] Loi sur les brevets (L.R.C. (1985), ch. P-4)
[9] Ce délai sera sujet à changement une fois entré en vigueur l’Accord États-Unis-Mexique-Canada, qui prolonge à 10 ans la protection des données, mais seulement dans le cas des médicaments biologiques. Gouvernement du Canada, Note d’information sommaire : L’Accord États-Unis-Mexique-Canada (AEUMC).
[10] Règlement sur les aliments et drogues (C.R.C., ch. 870) et Santé Canada, Ligne directrice : La protection des données en vertu de l’article C.08.004.1 du Règlement sur les aliments et drogues.
[11] Médecins Sans Frontières, Mémoire au Comité permanent de la santé, Recherche en santé subventionnée par le fédéral (M-132), octobre 2018.
[12] HESA, Témoignages, 1re session, 42e législature, 16 octobre 2018, 0920 (Aled Edwards, chef de la direction, Structural Genomics Consortium) et HESA, Témoignages, 1re session, 42e législature, 18 octobre 2018 (Louise Kyle, membre du comité de coordination pour l’Amérique du Nord, et Rachel Kiddell-Monroe, membre du conseil, Universités alliées pour les médicaments essentiels, et Jason Nickerson, conseiller aux affaires humanitaires, Médecins Sans Frontières).
[13] Comité permanent de la santé de la Chambre des communes (HESA), Témoignages, 1re session, 42e législature, 18 octobre 2018, 0905 (Louise Kyle).
[14] University College London, The people’s prescription: Re-imagining health innovation to deliver public value, document d’information remis au HESA, octobre 2018.
[15] Conseil d’examen du prix des médicaments brevetés, CompasRx, 4e édition : Rapport annuel sur les dépenses des régimes publics d’assurance-médicaments, 2016-2017, septembre 2018 et HESA, Témoignages, 1re session, 42e législature, 18 octobre 2018, 0905 (Kyle).
[16] Ibid.
[17] HESA, Témoignages, 18 octobre 2018, 0855 (Nickerson).
[18] University College London, The people’s prescription: Re-imagining health innovation to deliver public value, document d’information remis au HESA, octobre 2018.
[19] HESA, Témoignages, 18 octobre 2018, 0855 (Nickerson).
[20] Ibid.
[21] Ibid., 0900 (Kiddell-Monroe) et 0855 (Nickerson).
[22] Ibid., 0900 (Kiddell-Monroe).
[23] Ibid., 0940 (Nickerson).
[24] Structural Genomics Consortium, Étude M-132 du Comité permanent de la santé - Note d’information du Consortium en génomique structurelle : Recommandations stratégiques particulières, 17 octobre 2018.
[25] HESA, Témoignages, 1re session, 42e législature, 16 octobre 2018, 0955 (Edwards).
[26] Structural Genomics Consortium, Étude M-132 du Comité permanent de la santé - Note d’information du Consortium en génomique structurelle : Recommandations stratégiques particulières, 17 octobre 2018.
[27] HESA, Témoignages, 16 octobre 2018, 1005 (Salim Yusuf, professeur éminent de médecine, Institut de recherche de la santé de la population, McMaster University et Hamilton Health Sciences, à titre personnel, et Aled Edwards).
[28] Universities for Essential Medicines (UAEM), Présentation du groupe Universities Allied for Essential Medicines (UAEM) au Comité permanent de la santé aux fins de son étude sur l’augmentation des avantages issus de la recherche sur la santé financée par le gouvernement fédéral, les objectifs étant de réduire le coût des médicaments et d’accroître l’accès à ces derniers au Canada et à l’étranger (M-132), octobre 2018.
[29] Médecins Sans Frontières, Mémoire au Comité permanent de la santé, Recherche en santé subventionnée par le fédéral (M-132), octobre 2018.
[30] Mariana Mazzucato, professeure d’économie de l’innovation et de la valeur publique à University College London, Présentation au Comité permanent de la santé (HESA) – Étude sur la recherche en santé financée par des fonds fédéraux (M-132), octobre 2018.
[31] HESA, Témoignages, 16 octobre 2018, 1005 (Edwards).
[32] Ibid. et HESA, Témoignages, 18 octobre 2018, 0930 (Kiddell‑Monroe).
[33] Ibid., 1005 (Edwards).
[34] Instituts de recherche en santé du Canada (IRSC), Les IRSC en chiffres (2017-2018).
[35] HESA, Témoignages, 16 octobre 2018, 0855 (Yusuf).
[36] Ibid.
[37] Ibid.
[38] Ibid.
[39] Ibid., 0905 (Yusuf).
[40] Ibid., 0940 (Yusuf).
[41] Ibid. et HESA, Témoignages, 16 octobre 2018, 0930 (Keith Fowke, professeur, Département de la microbiologie médicale et des maladies infectieuses, Université du Manitoba).
[42] Instituts de recherche en santé du Canada, Motion M-132 sur l’utilisation de la recherche subventionnée par le gouvernement fédéral pour améliorer l’accès aux médicaments, mémoire, 22 octobre 2018.
[43] Drugs for Neglected Diseases initiative (DNDi), Mémoire présenté par la Drugs for Neglected Diseases initiative (DNDi), Amérique du Nord au Comité permanent de la santé (HESA) - Étude sur la recherche en santé subventionnée par le fédéral (M-132), octobre 2018.
[44] HESA, Témoignages, 16 octobre 2018, 0920 (Edwards).
[45] Ibid., 1100 (Maxwell Morgan, directeur, Politiques et conseiller juridique, Structural Genomics Consortium).
[46] HESA, Témoignages, 18 octobre 2018, 1035 (Kiddell-Monroe).
[47] HESA, Témoignages, 16 octobre 2018, 0920 (Edwards).
[48] HESA, Témoignages, 18 octobre 2018, 0855 (Nickerson).
[49] Ibid., 0910 (Kiddell-Monroe).
[50] Ibid.
[51] Structural Genomics Consortium, Étude M-132 du Comité permanent de la santé - Note d’information du Consortium en génomique structurelle : Recommandations stratégiques particulières, 17 octobre 2018.
[52] HESA, Témoignages, 16 octobre 2018, 0910 (M. Marc LePage, président et chef de la direction, Génome Canada).
[53] Structural Genomics Consortium, Étude M-132 du Comité permanent de la santé - Note d’information du Consortium en génomique structurelle : Recommandations stratégiques particulières, 17 octobre 2018.
[54] HESA, Témoignages, 18 octobre 2018, 0915 (Karen Lee, vice-présidente nationale, Recherche, Société canadienne de la sclérose en plaques).
[55] HESA, Témoignages, 16 octobre 2018, 0845 (Fowke).
[56] HESA, Témoignages, 18 octobre 2018, 1020 (Kiddell‑Monroe).
[57] HESA, Témoignages, 16 octobre 2018, 0905 (Yusuf).
[58] Dr Salim Yusuf, professeur éminent de médecine, Institut de recherche de la santé de la population, McMaster University et Hamilton Health Sciences, La recherche biomédicale au Canada, mémoire présenté au HESA, octobre 2018 et HESA, Témoignages, 18 octobre 2018, 0855 (Nickerson).
[59] HESA, Témoignages, 18 octobre 2018, 0855 (Nickerson).