HESA Rapport du Comité
Si vous avez des questions ou commentaires concernant l'accessibilité à cette publication, veuillez communiquer avec nous à accessible@parl.gc.ca.
l’APPROVISIONNEMENT EN MÉDICAMENTS AU CANADA :
|
Il est difficile […] de déterminer l’ampleur du problème [des pénuries de médicaments] au Canada, parce que les fabricants ne sont pas tenus de signaler les ruptures d’approvisionnement en médicaments et parce qu’il n’existe pas un unique organisme canadien justiciable qui surveille la distribution des médicaments dans l’ensemble du système. Brian O’Rourke, ACMTS, 3 avril 2012> |
À l'heure actuelle, nous estimons qu'en adoptant un mode d'attribution de contrat unisource, on élimine la concurrence, on élimine le choix, et on n'est pas en mesure de s'ajuster plus tard. Russell Williams, Rx&D, 27 mars 2012> |
COMMENTAIRES DES INTERVENANTS
1. Sécurité des patients
Il importe peu qui récolte les profits rattachés aux soins de santé, pourvu qu'on réponde aux besoins des patients.
Gail Attara, Coalition pour de meilleurs médicaments, 29 mars 2012
Le Comité a appris que le paysage des soins de santé s’est transformé au fil des ans. Autrefois dominé par les interventions chirurgicales ou pharmaceutiques à court terme, il est courant aujourd’hui que les patients suivent un traitement médicamenteux prolongé, souvent composé de multiples ordonnances. Le Comité a appris qu’il est particulièrement difficile de changer les régimes médicamenteux des patients qui suivent un traitement à long terme, et que les personnes atteintes de maladies chroniques ou potentiellement mortelles doivent pouvoir compter sur un approvisionnement continu. Des témoins ont décrit les difficultés que pose la recherche de solutions de rechange pour les patients. Ils ont souligné que les médicaments de rechange sont parfois plus coûteux, pas toujours accessibles et peuvent être inefficaces ou inappropriés pour certains patients en raison de leurs effets indésirables. De plus, un changement d’ordonnance peut entraîner la modification de la prise des médicaments, ce qui peut compliquer la tâche des patients et des personnes qui les soignent. La SCPH a souligné que son travail est beaucoup plus complexe et que les risques pour les patients sont plus élevés lors d’une pénurie de médicaments. Comme elle l’a expliqué, son rôle lors des ruptures d’approvisionnement en médicaments consiste à trouver des médicaments de rechange ou d’autres concentrations, dosages ou formes posologiques du même médicament, ainsi qu’à préparer des médicaments à partir de matières premières. Le Comité a appris que cette situation est susceptible de compliquer encore davantage le régime de traitement et qu’elle accroît les risques d’erreur lors de la prescription, de la préparation et de l’administration des médicaments et du suivi de la prise de la médication. Finalement, des défenseurs des droits des patients ont parlé de la frustration et de l’angoisse que les pénuries de médicaments provoquent chez les utilisateurs finaux, à savoir les Canadiens et les Canadiennes de tous âges qui comptent sur ces produits pour contrôler et traiter la douleur et la maladie. Ils ont insisté sur la nécessité d’inclure les groupes de patients dans le débat sur les pénuries de médicaments et dans la recherche de solutions au problème.
2. Attribution de contrats à un fournisseur exclusif
[Le] seul fabricant de nombreux médicaments a fait réaliser à l'ensemble des acteurs de notre système de santé la vulnérabilité qu'occasionne la dépendance à un fournisseur unique.
Diane Lamarre, l’Ordre, 29 mars 2012
Comme il a été indiqué précédemment, des témoins ont parlé de la pratique de plus en plus courante chez les OGA qui sont chargés d’acheter en vrac les médicaments pour le compte des hôpitaux d’attribuer des contrats exclusifs aux fabricants de produits génériques. Bien que cette pratique vise à maintenir les prix le plus bas possible, le Comité a aussi appris que l’attribution d’un contrat à fournisseur exclusif est la stratégie la plus sûre pour la prestation des soins de santé, car elle réduit les risques liés à un produit en particulier. On entend par là que des produits multiples, qui peuvent chacun avoir un protocole de livraison particulier, comportent un certain niveau de risque. Du point de vue des acheteurs en vrac des milieux hospitaliers, la précarité à laquelle conduit l’attribution d’un contrat à fournisseur exclusif serait mieux gérée si le fournisseur en question a d’autres sources d’approvisionnement en matières premières et en ingrédients actifs et s’il peut compter sur le concours d’autres usines de production en cas de nécessité.
3. Site Web sur les pénuries de médicaments
[N]ous comptons sur le groupe de travail pour continuer ces efforts, améliorer ces sites Web et veiller à ce qu'ils deviennent graduellement plus exacts.
David Johnston, ACGAP, 27 mars 2012
Les témoins ont fréquemment évoqué les travaux du groupe de travail sur les pénuries de médicaments. Bien que les témoins se soient tous dits favorables au nouveau site Web national bilingue d’information sur les pénuries de médicaments, plusieurs d’entre eux ont fait observer que ce site est financé et exploité par l’industrie pharmaceutique et que les sociétés pharmaceutiques n’ont pas l’obligation d’y communiquer l’information sur les ruptures d’approvisionnement. Des témoins ont avancé que les renseignements diffusés sur les deux sites Web de la Saskatchewan et du Québec sont insuffisants.
Plusieurs témoins, tout en appuyant les efforts déployés jusqu’à présent pour établir un site Web national sur les pénuries de médicaments, ont exprimé leur préférence pour la déclaration obligatoire[9]. Ils ont suggéré que les considérations financières empêchent les fabricants pharmaceutiques de respecter leur responsabilité morale d’aviser les intervenants d’une rupture d’approvisionnement dans les meilleurs délais. Des témoins ont également exprimé des réserves quant au fait que le site Web soit exploité par des fabricants de médicaments.
Le Comité a appris que la ministre de la Santé a trouvé encourageant qu’en réponse à sa lettre demandant une plus grande transparence au sujet des pénuries de médicaments, les associations de l’industrie aient clairement demandé à leurs membres de déclarer publiquement les pénuries appréhendées ou réelles. En outre, les acheteurs de médicaments peuvent contraindre les fournisseurs, au nom de leurs clients provinciaux et territoriaux, à faire de telles déclarations s’ils ajoutent, à leurs contrats d’approvisionnement, cette exigence en même temps que l’obligation faite aux fournisseurs d’avoir un plan de secours pour le cas où ils seraient incapables de répondre à la demande.
4. Programmes de Santé Canada
Afin de sélectionner des médicaments de rechange et de s'en procurer, les pharmaciens consultent la Base de données sur les produits pharmaceutiques de Santé Canada [...] et le Programme d'accès spécial.
Myrella Roy, SCPH, 29 mars 2012
Comme il a été mentionné précédemment, au Canada, la réglementation exige que les fabricants avisent Santé Canada qu’ils abandonnent la vente d’un médicament dans les 30 jours suivant la fin de la vente. Santé Canada peut alors consigner cette information dans sa Base de données sur les produits pharmaceutiques (BDPP), qui est une base de données publique et interrogeable sur les médicaments approuvés au Canada et dont les fabricants ont indiqué qu’ils sont commercialisés ici. La BDPP indique l’état (actif ou discontinué) de chaque médicament. Le Comité a appris que l’information sur l’état d’un médicament n’est pas toujours exacte, ce qui peut nuire à la capacité des fournisseurs de soins de santé de trouver d’autres options de traitement pour leurs patients.
Le Programme d'accès spécial (PAS) de Santé Canada est conçu pour permettre aux fournisseurs de soins de santé des médicaments et des appareils médicaux dont la vente au Canada n’a pas été approuvée. Le volet « médicaments » du PAS vise à offrir des options de traitement aux personnes atteintes d’une maladie grave ou potentiellement mortelle lorsque les traitements habituels se sont révélés inefficaces, ne conviennent pas ou ne sont pas disponibles. Les ruptures d’approvisionnement en médicaments ne sont qu’une des situations pour lesquelles le PAS a été créé. Le Comité a appris que les récentes pénuries ont fait ressortir le besoin de moderniser le PAS, car le processus est long et fastidieux.
5. Médicaments de nécessité médicale
Nous devons désormais planifier plus en amont pour éviter [que la situation] ne se répète.
Joel Lexchin, à titre personnel, 3 avril 2012
Un certain nombre de témoins ont indiqué au Comité qu’il faudrait identifier et répertorier les médicaments de première nécessité, ou de nécessité médicale, jugés indispensables et fournis uniquement par un ou deux fournisseurs, et qu’il faudrait suivre de près leur approvisionnement. Il a été suggéré qu’une telle liste indique les options de traitement possibles en cas de rupture d’approvisionnement. Des fournisseurs de soins de santé ont insisté sur le fait que les fabricants de médicaments ont l’obligation morale de fiabiliser la chaîne d’approvisionnement en médicaments de première nécessité. Dans cet esprit, certains témoins ont indiqué qu’il serait souhaitable de resserrer les exigences réglementaires et contractuelles de ces fournisseurs afin d’assurer cette fiabilité, reconnaissant qu’une telle mesure est de compétence provinciale.
6. Établissement des prix des médicaments et politiques
Les prix à l'échelle mondiale diminuent pour certains de ces produits, et, par conséquent, il y a moins d'entreprises qui peuvent exister commercialement en fabriquant ces produits.
Jim Keon, ACMG, 27 mars 2012
L’établissement du prix des produits pharmaceutiques brevetés est réglementé par le Conseil d’examen du prix des médicaments brevetés (CEPMB). Le CEPMB s’assure que les produits médicamenteux brevetés sont vendus à des prix raisonnables. Pour ce faire, il compare le prix de chaque médicament dans sept autres pays, à savoir la France, l’Allemagne, l’Italie, la Suède, la Suisse, le Royaume-Uni et les États-Unis.
Lorsqu’un produit pharmaceutique n’est plus protégé par un brevet, il est alors possible de soumettre à Santé Canada des versions génériques du produit à des fins d’approbation. Comme des témoins l’ont expliqué, une fois ces versions approuvées, on en établit le prix en fonction de deux systèmes d’établissement de prix de réglementation provinciale, soit un système pour les hôpitaux et un système pour les pharmacies de détail. Le Comité a appris que les provinces et les territoires ont chacun la responsabilité d’acheter leurs médicaments et que ce processus se fait en vase clos. Le Comité a également appris que les produits pharmaceutiques sont achetés en vrac pour les hôpitaux; on privilégie les versions génériques dans la mesure du possible, car elles sont plus abordables que les marques d’origine. Ces achats en vrac sont effectués par les OGA au moyen d’un processus d’appel d’offres. Ce processus est assujetti à la réglementation provinciale sur le commerce intérieur et les appels d’offres.
Le deuxième système d’établissement des prix vise les pharmacies de détail. Les lois provinciales imposent parfois des restrictions sur les prix des produits génériques inscrits sur les formulaires. Par exemple, comme le Comité l’a appris, l’Ontario a récemment modifié sa réglementation des prix de façon à plafonner le prix des médicaments génériques à 25 % du prix de leur équivalent d’origine. Toutefois, le Comité a appris que les provinces peuvent, dans une certaine mesure, déroger à cette règle lorsque le coût d’un médicament vendu dans une pharmacie de détail est plus élevé et que le plafonnement du prix devient si bas qu’il dissuade les sociétés pharmaceutiques de produire le médicament en question. Le Comité a également appris que la réglementation du Québec prévoit que la province ne paiera pas davantage que les autres provinces pour les médicaments génériques.
Selon les renseignements que le Comité a recueillis, le prix de détail des médicaments génériques est concurrentiel à l’échelle internationale et, partout dans le monde, on constate une réduction du prix de plusieurs médicaments génériques. Par conséquent, le nombre de sociétés pharmaceutiques qui produisent ces médicaments génériques diminue, ce qui freine la concurrence, favorise l’attribution de contrats à un fournisseur exclusif et limite l’accès aux médicaments.
UN RÔLE POUR CHACUN
En effet, la question des pénuries de médicaments exige l'attention et la collaboration de tous ‒ nous, comme innovateurs, les génériques, tous les gouvernements, les professionnels de la santé et tous les autres ‒ qui jouent un rôle dans la fourniture ou le système d'approvisionnement de médicaments aux Canadiens.
Russell Williams, Rx&D, 27 mars 2012
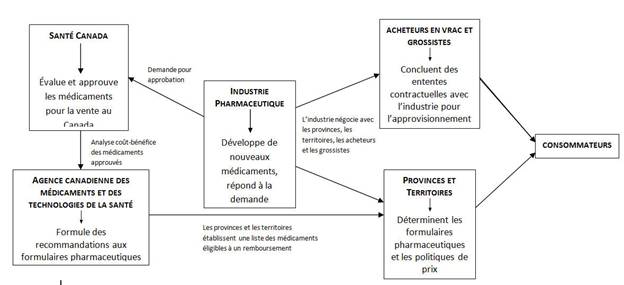
Au cours des trois réunions, le Comité a fréquemment entendu que, au Canada, la chaîne d’approvisionnement en médicaments compte de multiples acteurs et qu’ils peuvent tous jouer un rôle pour accroître la fiabilité de l’approvisionnement en médicaments.
Santé Canada est chargé d’approuver les nouveaux médicaments pour qu’ils puissent être vendus sur le marché canadien; à ce chapitre, le Ministère a admis avoir du retard dans l’approbation des médicaments génériques. Toutefois, le Comité a appris que les récentes modifications apportées aux frais que les sociétés pharmaceutiques doivent payer à Santé Canada pour soumettre leurs médicaments ont permis au Ministère d’accroître ses ressources et d’améliorer ses délais de traitement. Résultat : Santé Canada a indiqué être désormais capable de traiter plus rapidement les demandes d’approbation de médicaments génériques et d’autoriser la vente d’un plus grand nombre de médicaments génériques sur le marché canadien. Le Comité a cependant appris que les formulaires pharmaceutiques provinciaux peuvent ne répertorier qu’une seule option générique, même s’il en existe plusieurs. Malheureusement, les fonctionnaires provinciaux qui avaient été conviés à venir témoigner devant le Comité ont décliné l’invitation à comparaître. Par conséquent, le Comité n’a entendu aucun représentant provincial dont le témoignage lui aurait permis d’examiner plus avant le rôle des formulaires pharmaceutiques et des politiques tarifaires ou des processus d’appels d’offres pertinents dans le contexte de la fiabilité de l’approvisionnement en médicaments. De plus, le Comité comprend que l’examen accéléré de plus de 40 soumissions a maintenant permis d’approuver plus de 20 médicaments, ce qui pourrait aider à remédier aux pénuries actuelles, bien qu’on ne sache pas précisément à quel moment ces médicaments seront commercialisés. En outre, les représentants de Santé Canada ont informé le Comité que le Ministère avait approuvé l’ajout de 10 autres sites étrangers à la liste des sites autorisés de Sandoz aux fins de la fabrication et de la mise à l’essai de médicaments destinés au marché canadien.
Des témoins ont aussi parlé du rôle de Santé Canada pour obliger les fabricants à déclarer l’abandon de la vente d’un produit au Canada et de la façon dont cette information et d’autres données doivent être conservées à jour dans la BDPP du Ministère. Le Comité a obtenu des renseignements sur la responsabilité de Santé Canada par rapport au PAS, et des fonctionnaires ont indiqué que le Ministère a approuvé 59 demandes aux fins du Programme en raison des pénuries de médicaments. Des fonctionnaires de Santé Canada ont informé le Comité que l’Agence de la santé publique du Canada (ASPC) exploite le Système de la réserve nationale d'urgence (SRNU) et que, bien que le SRNU soit depuis peu accessible aux provinces en réponse aux pénuries, il n’a fait l’objet d’aucune demande.
Certains témoins sont d’avis que le gouvernement fédéral doit être plus actif sur la scène mondiale, et l’APhC a indiqué que les provinces et les territoires attendent du fédéral non seulement qu’il relaie l’information obtenue à l’échelle internationale, mais aussi qu’il soulève leurs préoccupations dans les tribunes mondiales. Certains témoins ont exhorté Santé Canada à porter la question des pénuries de médicaments à l’attention de l’Organisation mondiale de la Santé et de l’Organisation de coopération et de développement économiques afin qu’elle soit rigoureusement analysée sous un angle international.
Des fabricants ont avancé que, souvent, ils n’ont d’autre choix que de se procurer les matières premières et les ingrédients actifs dont ils ont besoin auprès d’un fournisseur unique, principalement en raison de la chute des prix. Ils ont également avancé que la faiblesse des marges de profit expliquerait pourquoi de moins en moins de sociétés produisent certains médicaments génériques ou pourquoi le nombre d’usines en mesure d’en produire ne cesse de diminuer. Le Comité a appris de l’industrie de fabrication des médicaments d’origine que la pratique d’attribuer un contrat à un fournisseur exclusif une fois qu’un médicament n’est plus breveté écarte la concurrence; toutefois, ils n’ont pas indiqué si l’industrie adhère à la politique de pratiquer des prix concurrentiels lorsque les produits ne sont plus protégés par un brevet, une politique qui a cours parmi ses membres. Certains témoins ont parlé de la responsabilité morale des fabricants de médicaments de maintenir la production des médicaments de première nécessité ou essentiels. Les sociétés pharmaceutiques doivent évaluer cette obligation morale en fonction des profits décroissants lorsqu’elles décident de commercialiser des médicaments génériques au Canada.
Je pense en fait que le gouvernement a joué un rôle important pour que nous travaillions ensemble en vue de trouver une solution.
Russell Williams, Rx&D, 27 mars 2012
Le Comité a également appris que la ministre de la Santé a commencé à se préoccuper vivement, il y a un an, du problème mondial que posent les pénuries de médicaments, qui sont de plus en plus fréquentes; elle a écrit aux associations de l’industrie, dont l’APhC, pour leur demander de travailler ensemble pour explorer des façons de réduire l’incidence des pénuries de médicaments à l’avenir et d’améliorer la transparence. Cela permettrait d’améliorer le mécanisme de notification au sein du système de santé en cas de pénurie de médicaments et de faciliter les interventions. Le Comité s’est également fait dire que les fabricants de médicaments ont, dans l’ensemble, une bien plus grande part de responsabilité morale par rapport aux soins de santé au Canada. En effet, la permission de faire des profits dans le système de soins de santé canadien devrait aller de pair avec un engagement envers les soins aux patients en assurant un approvisionnement stable. Les fabricants mondiaux de médicaments doivent s’assurer que les plans visant à corriger les problèmes ne nuisent pas, dans une large mesure, à la production des produits pharmaceutiques offerts au Canada.
Les acheteurs en vrac ont indiqué qu’ils entendent modifier leurs pratiques d’appel d’offres de façon à réduire leur dépendance à l’égard des fournisseurs uniques. Ils ont avancé qu’ils peuvent y parvenir soit en accordant un contrat à un fournisseur secondaire, soit en obligeant le fournisseur à disposer de plans de secours en cas de rupture d’approvisionnement. Le Comité note que, selon certains témoignages, les fournisseurs pourraient en fait avoir avec les acheteurs en vrac l’obligation contractuelle de respecter les quotas d’approvisionnement, mais que les contractants ne font pas forcément observer ces modalités. De plus, les grossistes et les distributeurs doivent faire leur part pour fiabiliser l’approvisionnent en médicaments. Le Comité a appris que leur organisme-cadre l’ACGAP fait partie du groupe de travail sur les pénuries de médicaments. Le Comité a également appris que les grossistes et les distributeurs jouent un rôle fondamental pour que les médicaments soient distribués d’une façon juste et équitable.
L’ACMTS a fait connaître sa volonté d’assumer des responsabilités charnières dans le cadre d’une stratégie de gestion de l’approvisionnement en médicaments pour prévenir et atténuer les ruptures d’approvisionnement. Le Comité a appris qu’en raison de son rôle actuel, qui consiste à évaluer le rapport coût-efficacité des médicaments approuvés par Santé Canada et à fournir des recommandations d’inscription sur les formulaires des régimes fédéraux, provinciaux et territoriaux participants, l’ACMTS est tout indiquée pour fournir des conseils cliniques sur les médicaments de rechange dans l’éventualité d’une pénurie. L’ACMTS a également suggéré qu’elle serait capable d’établir une liste de médicaments de première nécessité qui ne sont disponibles qu’auprès d’un ou deux fournisseurs. Lorsqu’il a été question de savoir s’il est opportun que le site Web sur les pénuries de médicaments soit exploité par l’industrie pharmaceutique, il a été suggéré que l’ACMTS pourrait être un choix mieux indiqué.
Finalement, le Comité applaudit les efforts des utilisateurs finaux, à savoir les professionnels de la santé et les patients. Il reconnaît leur rôle fondamental et les encourage à continuer de participer et à demeurer vigilants. Leur voix est essentielle pour réussir à obliger les fabricants de médicaments à répondre de leurs actes.
RECOMMANDATIONS DU COMITÉ
Des renseignements au sujet du problème des pénuries de médicaments ne peuvent se substituer à des solutions au problème.
John Haggie, AMC, 29 mars 2012
1. Médicaments essentiels et traitements de rechange
Le Comité applaudit la création du Groupe de travail multi-intervenants sur les pénuries de médicaments et convient qu’il s’agit d’un premier pas positif pour renforcer la fiabilité de l’approvisionnement en médicaments au Canada. Toutefois, le Comité prend note des préoccupations de certains témoins sur le fait qu’une liste de médicaments essentiels devrait être établie et que des traitements de rechange soient identifiés.
Par conséquent, le Comité recommande :
Que la ministre de la Santé, en consultation avec les provinces et les territoires, étudie la possibilité que l’Agence canadienne des médicaments et des technologies de la santé établisse une liste des médicaments qui ne sont fournis que par une ou deux sociétés pharmaceutiques et qui sont considérés comme étant essentiels aux soins médicaux;
Que la ministre de la Santé, en consultation avec les provinces et les territoires, demande que l’Agence canadienne des médicaments et des technologies de la santé communique l’information clinique sur le recours à des traitements de rechange.
2. Déclaration
Le Comité comprend les préoccupations des témoins qui demandent instamment que la déclaration sur le site Web soit obligatoire et non volontaire. Toutefois, il propose que le rôle de Santé Canada se limite à surveiller les abandons, et il suggère que la déclaration obligatoire des ruptures temporaires serait mieux contrôlée à l’échelle provinciale ou au moyen d’obligations contractuelles avec des OGA. Au chapitre de l’attribution de contrats à un fournisseur exclusif, le Comité a entendu à maintes reprises que, peu importe si cette pratique est attribuable au processus d’appel d’offres, à l’absence de traitements de rechange approuvés au Canada ou au fait qu’un fabricant n’a qu’un seul fournisseur de matières premières ou d’ingrédients actifs, elle rend les Canadiens et les Canadiennes vulnérables aux ruptures d’approvisionnement. Le Comité comprend que tous les intervenants ont un rôle à jouer afin de minimiser, voire éliminer, le recours à cette pratique.
Par conséquent, le Comité recommande :
Que Santé Canada envisage de modifier l’exigence réglementaire pour les fabricants de l’aviser qu’ils ont abandonné la vente d’un produit dans les 30 jours suivant la fin de la vente au Canada, de façon à ce qu’ils doivent donner un préavis de six mois pour les abandons planifiés;
Que la ministre de la Santé travaille avec ses homologues provinciaux et territoriaux pour inciter les organismes de groupement d’achats, les responsables des régimes d’assurance-médicaments et les autres signataires d’ententes contractuelles avec des sociétés pharmaceutiques:
· à obliger les sociétés pharmaceutiques à déclarer toute rupture d’approvisionnement sur le site Web sur les pénuries de médicaments; et,
· à dissuader le recours à l’attribution de contrats à un fournisseur exclusif et à inclure l’obligation, pour les fournisseurs, d’avoir préparé des plans de secours dans l’éventualité où ils seraient incapables de répondre à la demande.
3. Politiques d’établissement des prix
Le Comité partage les préoccupations de plusieurs témoins concernant l’absence de compétitivité au sein de l’industrie des médicaments génériques en raison du fléchissement des prix et de la faiblesse des marges de profit associées à ces produits. Toutefois, il n’a pas entendu suffisamment de témoignages à cet égard pour tirer des conclusions et proposer des solutions. Même s’il reconnaît que l’autorité du gouvernement fédéral est limitée dans ce domaine, le Comité propose que Santé Canada joue un rôle de premier plan à ce chapitre en vue de promouvoir une stratégie nationale.
Par conséquent, le Comité recommande :
Que la ministre de la Santé encourage ses homologues provinciaux et territoriaux à amorcer un examen des politiques d’établissement des prix des médicaments qui relèvent de leur compétence, ce qui comprend les restrictions sur le prix des médicaments génériques et les exigences en matière d’appel d’offres et de passation de marchés, afin d’établir leur incidence sur l’approvisionnement en médicaments.
4. Programmes fédéraux existants
Santé Canada a indiqué que, en plus d’approuver les médicaments, il est également responsable de maintenir la BDPP et le PAS. De l’avis des intervenants, ces deux outils sont utiles pour gérer une pénurie de médicaments. Toutefois, il est nécessaire que la BDPP soit à jour et que le PAS puisse répondre le plus rapidement possible aux besoins urgents qui surgissent en situation de crise. Le Comité se dit encouragé par l’attention que le Ministère porte à ses programmes à cet égard. Le Comité note que, bien que l’ASPC ait annoncé que le SRNU serait disponible pendant cette pénurie de médicaments, il ne semble pas y avoir de politique générale concernant son utilisation lors de pénuries de médicaments de première nécessité.
Par conséquent, le Comité recommande :
Que l’Agence de la santé publique du Canada élabore une politique sur le rôle du Système de la réserve nationale d’urgence lors des pénuries de médicaments essentiels.
5. Présence à l’échelle internationale
Plusieurs témoins ont souligné que la question de l’approvisionnement en médicaments et du problème de pénuries est d’ordre mondial. Le Comité convient que le gouvernement fédéral doit assurer une forte présence sur la scène internationale pour soulever les préoccupations de nos intervenants dans les tribunes mondiales. Ainsi, le gouvernement fédéral peut mettre en commun des pratiques exemplaires, apprendre d’autres pays et présenter par la suite de nouvelles données aux gouvernements provinciaux et territoriaux ainsi qu’aux organisations professionnelles.
Par conséquent, le Comité recommande :
Que la ministre de la Santé maintienne sa collaboration avec l’Organisation mondiale de la Santé et l’Organisation de coopération et de développement économiques pour régler la question des pénuries de médicaments afin que les causes mondiales du problème et les solutions potentielles puissent être examinées.
CONCLUSION
Le Comité reconnaît que de nombreux acteurs participent à la mise sur pied d’une stratégie nationale d’anticipation, d’atténuation et de gestion des pénuries de médicaments, et il applaudit les efforts qu’ont déployés tous les intervenants en ce sens jusqu’à présent. Compte tenu de l’augmentation de la fréquence et de la durée des pénuries de médicaments ces dernières années, le Comité s’attend à ce que tous les intervenants fassent un effort concerté pour qu’une stratégie d’ensemble soit mise sur pied le plus rapidement possible.
[1] Les six régimes fédéraux d’assurance-médicaments sont administrés par Santé Canada (Premières nations et Inuits admissibles), le ministère des Anciens Combattants (anciens combattants admissibles), le ministère de la Défense nationale (membres des Forces canadiennes), la Gendarmerie royale du Canada (membres réguliers et retraités admissibles), le Service correctionnel du Canada (détenus sous responsabilité fédérale admissibles) et Citoyenneté et Immigration Canada (réfugiés et personnes détenues par CIC admissibles).
[2] Santé Canada, 3 avril 2012.
[3] Ibid.
[4] Ibid.
[5] Ibid.
[6] Le site Web peut être consulté à http://druginfo.usask.ca/healthcare_professional/drug_shortages.php.
[7] Le site Web peut être consulté à http://vendredipm.wordpress.com/.
[8] Les compagnies de recherche pharmaceutique du Canada, 27 mars 2012.
[9] Ordre des pharmaciens du Québec et Société canadienne des anesthésiologistes, 29 mars 2012; HealthPRO Procurement Services Inc., 27 mars 2012; Alliance canadienne de l'épilepsie (soumission écrite).